Übungs-Materialien für die 3.
Chemie-Kurzarbeit 9a bzw. 9cSG
Thema: Chemische Bindungen (Ionenbindung,
Atombindung, Metallbindung)
(Chemisch typische) Metalle reagieren mit (chemisch
typischen) Nichtmetallen zu Salzen. Es entsteht eine
Ionenbindung.
Nichtmetalle reagieren mit sich selbst oder mit anderen
Nichtmetallen zu Molekülen. Es entsteht eine
Atombindung.
„Motivation“ ist beidesmal die Erreichung einer
Edelgas-Elektronenkonfiguration (vereinfacht: Oktett) für
beide/alle Bindungspartner.
Salze - Ionenbindung
|
Wichtig:
|
Metalle haben die Tendenz Elektronen abzugeben und Kat-Ionen
(positiv geladene Ionen) zu bilden!
|
|
|
Nichtmetalle haben die Tendenz Elektronen aufzunehmen und
An-Ionen (negativ geladene Ionen) zu bilden!
|
Aus der Hauptgruppen-Nummer lässt sich leicht ermitteln,
wieviele Elektronen ein Metall-Atom abgeben muß, um die
vorhergehende Edelgas-Elektronenkonfiguration zu erreichen, bzw.
wieviele Elektronen ein Nichtmetall-Atom aufnehmen muß, um die
nachfolgende Edelgas-Elektronenkonfiguration zu erreichen.
Beispiele:
|
Element
|
Element- Symbol
|
HG- Nr
|
Aufnahme / Abgabe
|
Anz. e-
|
bildet Kation / Anion
|
Ionen- Name
|
Ionen- Formel
|
Wertigkeit
|
erreicht Edelgas- Elektronen- konfiguration von
|
|
Natrium
|
Na
|
I
|
Abgabe
|
1
|
Kation
|
Natrium- Kation
|
Na+
|
1-wertig
|
[Ne]
|
|
Calcium
|
Ca
|
II
|
Abgabe
|
2
|
Kation
|
Calcium- Kation
|
Ca2+
|
2-wertig
|
[Ar]
|
|
Aluminium
|
Al
|
III
|
Abgabe
|
3
|
Kation
|
Aluminium- Kation
|
Al3+
|
3-wertig
|
[Ne]
|
|
Sauerstoff
|
O
|
VI
|
Aufnahme
|
2
|
Anion
|
Oxid- Anion
|
O2-
|
2-wertig
|
[Ne]
|
|
Chlor
|
Cl
|
VII
|
Aufnahme
|
1
|
Anion
|
Chlorid- Anion
|
Cl -
|
1-wertig
|
[Ar]
|
|
Schwefel
|
S
|
VI
|
Aufnahme
|
2
|
Anion
|
Sulfid- Anion
|
S2-
|
2-wertig
|
[Ar]
|
|
Stickstoff
|
N
|
V
|
Aufnahme
|
3
|
Anion
|
Nitrid- Anion
|
N3-
|
3-wertig
|
[Ne]
|
Entsprechende Kationen und Anionen bilden zusammen ein Salz. Die
Formel des Salzes läßt sich leicht aus den Wertigkeiten
der Ionen ermitteln. Die Summen der Kationenladungen und die Summen
der Anionenladungen müssen sich gegenseitig ausgleichen, da die
Salz-Formeleinheit insgesamt neutral sein muß!
Beispiele:
|
Salz-Namen
|
Kation
|
Kation- Wertigkeit
|
Anion
|
Anion- Wertigkeit
|
Salz-Formel
(ungekürzt)
|
Salz-Formel
(gekürzt)
|
|
Calciumchlorid
|
Ca2+
|
2
|
Cl -
|
1
|
Ca1Cl2
|
CaCl2
|
|
Aluminiumoxid
|
Al3+
|
3
|
O2-
|
2
|
Al2O3
|
Al2O3
|
|
Calciumnitrid
|
Ca2+
|
2
|
N3-
|
3
|
Ca3N2
|
Ca3N2
|
|
Calciumoxid
|
Ca2+
|
2
|
O2-
|
2
|
Ca2O2
|
CaO
|
Im Salzgitter halten sich die Kationen und die Anionen durch
elektrostatische Kräfte auf bestimmte Gitterplätze fest.
Diese elektrostatischen Kräfte heißen Ionenbindung.
Durch die Struktur der Salzgitter und die anziehenden und abstoßenden
Kräfte der Ionen sind Salze spröde, haben (i.a.)
einen hohen Schmelzpunkt und leiten nur in der
Schmelze oder als wässrige Lösung den
elektrischen Strom durch Ionenleitung.
Atombindung - Elektronenpaarbindung
Bei der Atombindung (zwischen 2 Nichtmetall-Atomen) benutzen 2
Elektronen gemeinsam ein Molekülorbital. Beide Atome sind damit
durch ein gemeinsames Elektronenpaar verbunden.
Durch die gemeinsam( benutzt)en Elektronen kann jeder
Bindungspartner eine Edelgas-Elektronenkonfiguration (ein Oktett)
erreichen.
Manche Atome können lediglich Einfachbindungen bilden, andere
können auch Doppelbindungen oder sogar Dreifachbindungen bilden.
Zum Aufstellen einer Elektronenformel muss man zuerst ermitteln,
wieviele der Valenzelektronen als sog. freie Elektronenpaare
vorliegen undwieviele bindungsfähige Valenzelektronen ein Atom
mitbringt :
Als Faustformel für die bindungsfähigen Elektronen kann
man die Anzahl der noch zum Oktett fehlenden Elektronen zugrunde
legen.
z.B.
|
Element
|
Anzahl Valenzelektronen
|
zum Oktett fehlen
|
Elektronenformel des Atoms
|
Wertigkeit bzw. Bindigkeit
|
|
Kohlenstoff, C
|
4
|
4
|
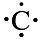
|
4-wertig bzw. 4-bindig
|
|
Stickstoff, N
|
5
|
3
|
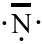
|
3-wertig bzw. 3-bindig
|
|
Sauerstoff, O
|
6
|
2
|

|
2-wertig bzw. 2-bindig
|
|
Chlor
|
7
|
1
|
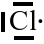
|
1-wertig bzw. 1-bindig
|
Zum Aufstellen einer Elektronenformel einer Verbindung, müssen
alle bindungsfähigen Elektronen der möglichen
Bindungspartner so miteinander verknüpft werden, dass kein
bindungsfähiges Elektron übrig bleibt! Es können
Kombinationen von Einfachbindungen und Zweifachbindungen oder
Dreifachbindungen auftreten. Die Bindigkeit jedes einzelnen Atoms
darf nicht überschritten werden! Die bindenden und die freien
Elektronenpaare sind am Ende so um ein Atom anzuordnen, dass sie
möglicht gleichmäßig voneinander entfernt sind
(Ausnahme: Doppelbindungen und Dreifachbindungen).
Zu beachten ist
dabei auch, dass keine Ringe mit weniger als 5 Atomen auftreten
dürfen!
Beispiel:
|
Kohlenstoffdioxid, CO2 :
|
„Bau- kasten“
|

|
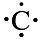
|

|
|
|
|
|
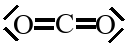
|
|
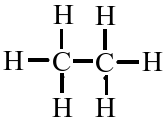
Ethan, C2H6
|
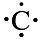
|
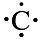
|
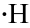
|
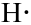
|
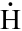
|
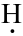
|
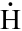
|
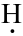
|
|
|
Ethanal, C2H4O
|
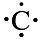
|
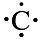
|

|
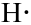
|
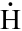
|
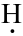
|
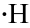
|
|
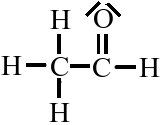
|
Übung: versucht die Elektronenformeln zu erstellen von
H2O,
H2CO3,
C2H6O (mind. 2 verschiedene!),
C6H12 (mind. 2 verschiedene!),
C2H2,
CH4N2O,
C4H10 (mind. 2 verschiedene!),
C4H10O (mind. 2 verschiedene!)
Lösungen hier
Zur Erinnerung:
C ist immer 4-bindig und kann Einfach-,
Zweifach- und Dreifachbindungen,
N ist immer 3-bindig und kann
Einfach-, Zweifach- und Dreifachbindungen,
O ist immer 2-bindig
und kann Einfach-, und Zweifachbindungen,
H ist immer 1-bindig und
kann nur Einfachbindungen!
zurück
![]()
![]()
![]()
![]()

